Waterstofkarbonaat
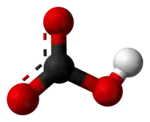
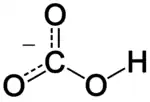
'n Waterstofkarbonaat of bikarbonaat is 'n sout wat die komplekse ioon HCO−3 bevat.
|
Algemeen | |
|---|---|
| Naam | Waterstofkarbonaat |
| Ander naam | bikarbonaat |
 |  |
| Termochemiese radius | 2,07 Å [1] |
| 44,3 [Scm2/mol][2] | |
| pKa | 10,33 |
| pKb | 14-6,35= 7,65 |
| Lys van anione | |

Die ioon is die geprotoneerde vorm van die karbonaat-ioon. Die sentrale koolstofatoom het 'n oksidasietoestand van +4. 'n Beskrywing van die binding in die karbonaatioon met die Lewisteorie lei tot twee sogenaamde resonansiestrukture wat aandui dat een van die bindende elektronpare nie net tussen 'n koolstof- en 'n suurstofatoom geplaas is nie, maar gedeel word deur drie atome van die ioon. 'n Beter beskrywing is moontlik met die molekulêre-orbitaalteorie en lei tot 'n bindingsorde van 1,5 vir die twee C-O bindings. In die Brønsted-teorie van sure en basisse is die waterstofkarbonaatioon die gekonjueerde basis van koolsuur en die gekonjugeerde suur van die karbonaat-ioon. Die ioon is amfiproties.
Bikaarbonate van die alkalimetale soos NaHCO3 en KHCO3 is oplosbaar, ander bikarbonate is dikwels in water meer oplosbaar as die ooreenkomstige karbonate.
Dit het gevolge in die natuur, veral omrede kalsiumkarbonaat, 'n belangrike mineraal, deur water wat opgeloste koolstofdioksied bevat oplosbaar gemaak kan word volgens die formule:
Die opgeloste kalsium kan deur die grond syfer en in grotte soos die Kangogrotte druipsteen vorm.
By verhitting ontbind bikarbonate volgens die reaksie:
Dit word gebruik as bakpoeier om deeg te laat oprys.
Sien ook
Verwysings
- Thermochemical Radii of Complex Ions Helen K. Roobottom, H. Donald B. Jenkins, Jack Passmore, Leslie Glasser Journal of Chemical Education 76(11) 1999, bls. 1570
- aqion.