Alifatiese verbinding
In organiese chemie word koolwaterstowwe (verbindings wat slegs uit koolstof en waterstof bestaan) in twee klasse verdeel: aromatiese verbindings en alifatiese verbindings (van Grieks aleiphar wat vet of olie beteken), ook bekend as nie-aromatiese koolwaterstowwe. Alifatiese verbindings kan siklies wees maar koolwaterstowwe met gekonjugeerde pi-stelsels wat Hückel se reel gehoorsaam word egter beskou as aromaties.[1] Alifatiese verbindings kan versadig wees, soos heksaan, of onversadig, soos hekseen en heksyn. Oopkettingverbindings (hetsy reguit of vertak) bevat geen ringe van enige aard nie en is dus alifaties.


Struktuur
Alifatiese verbindings kan versadig wees en verbind word deur enkelbindings (alkane), of onversadig, met dubbelbindings (alkene) of drievoudige bindings (alkyne). Behalwe waterstof, kan ander elemente aan die koolstofketting gebind word, waarvan suurstof, stikstof, swawel en chloor die algemeenste is.
Die eenvoudigste alifatiese verbinding is metaan (CH4).
Eienskappe
Die meeste alifatiese verbindings is vlambaar, wat die gebruik van koolwaterstowwe as brandstof moontlik maak, soos bv. metaan in gasvlamme en as vloeibare natuurlike gas, en asetileen (etyn) in die sweiswerk.
Voorbeelde
| Formule | Naam | Strukturele formule | Formule | Naam | Strukturele formule |
|---|---|---|---|---|---|
| CH4 | Metaan | 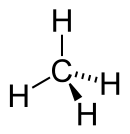 |
C2H2 | Asetileen | |
| C2H4 | Etileen |  |
C2H6 | Etaan |  |
| C3H4 | Propyn | C3H6 | Propeen |  | |
| C3H8 | Propaan | 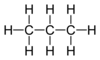 |
C4H6 | 1,2-Butadiëen |  |
| C4H6 | 1-Butyn |  |
C4H8 | 1-Buteen | |
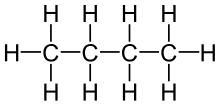
| C4H10 | Butaan |  |
C5H12 | n-pentaan | |
| C6H10 | Siklohekseen | C7H14 | sikloheptaan | ||
| C7H14 | Metielsikloheksaan |  |
C8H8 | Kubaan |  |
| C9H20 | Nonaan | C10H12 | Disiklopentadiëen | 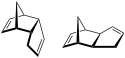 | |
| C10H16 | Fellandreen | 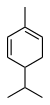  |
C10H16 | α-Terpineen | |
| C10H16 | Limoneen | -Limonen.svg.png.webp) -Limonen.svg.png.webp) |
C11H24 | Undekaan | |
| C30H50 | Skwaleen | C2nH4n | Poliëtileen |
Verwysings
- "aliphatic compounds". IUPAC Compendium of Chemical Terminology (in Engels). Research Triagle Park, NC: IUPAC. doi:10.1351/goldbook.a00217. ISBN 0-9678550-9-8.